
12月8日,又有一家未盈利的生物制藥公司向港交所遞交了招股書。
這叫公司名為科笛集團,公司是一家專注於皮膚學的研發型生物制藥公司,面向皮膚病治療及護理市場。
在科笛集團衝刺資本市場的背後,皮膚病市場是一個不能令資本忽視的大市場。
數據顯示,2021年,國内脫發患者人數達2.517億人;患有痤瘡、銀屑病、特應性皮炎和白癜風等疾病在内的皮膚病患者超過2億人;預計局部脂肪堆積管理市場的規模在2030年接近40億元。
科笛集團做好準備迎接這個尚待挖掘的大賽道嗎?
01 產品豐富,已商業化產品收益不佳
科笛集團是生物制藥行業中的後來者,在2019年才成立,成立當年就開始了特應性皮炎新藥和表皮麻醉膏的研發。
目前,科笛集團建立起了11個產品及候選產品組合,產品組合有三大類,分别是毛發疾病及護理、皮膚疾病及護理、局部脂肪堆積管理藥物以及表皮麻醉。
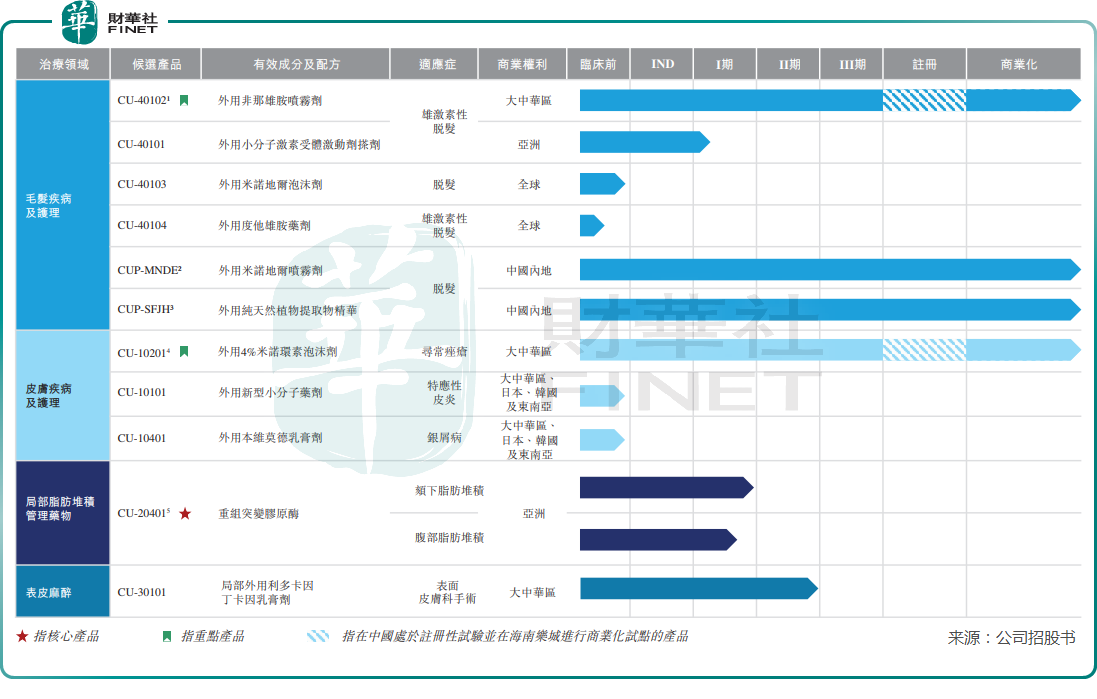
科笛集團當前已上市了兩款產品:CUP-MNDE及CUP-SFJH。CUP-MNDE屬噴霧劑,其應用了低濃度丙二醇配方技術,可促進頭發生長,與競爭對手米諾地爾酊劑及搽劑相比,經證實丙二醇的副作用要少得多;CUP-SFJH為植物提取物,用於防脫發及改善發質,在歐洲的一項小規模臨床觀察中證實,在使用六個月後,CUP-SFJH具有改善發量及前移發際線的療效。
值得留意的是,CUP-MNDE和CUP-SFJH並非是科笛集團的原創藥物,而是授權引進的產品。CUP-MNDE是由其原開發商Laboratoires Bailleul開發和商業化的,公司在去年9月獲得了CUP-MNDE在中國内地的獨家分銷及營銷權;CUP-SFJH則是由其原開發商VML開發和商業化,公司在去年6月獲得CUP-SFJH在中國内地的獨家分銷及營銷權。
儘管科笛集團商業化CUP-MNDE和CUP-SFJH的時間已超過一年,但商業化成效並不佳。在2021年,科笛集團才產生了203.8萬元的收益,2022年上半年也僅錄得65.8萬元的收益。
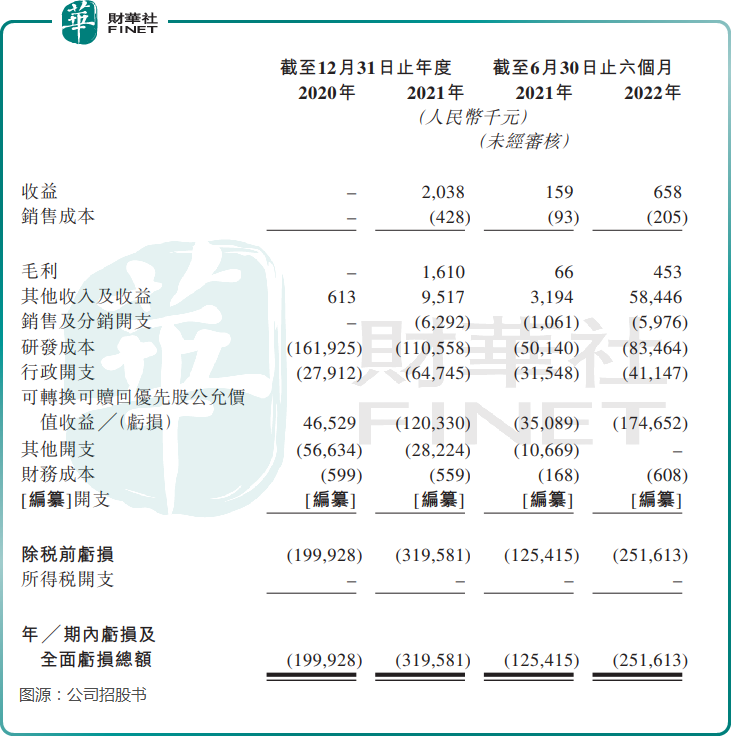
由於科笛集團大部分藥物處於研發階段,而發現及開發新候選產品及新制劑的研究項目需要耗費大量技術、財務及人力資源,且臨床試驗成本高昂,周期長,加上收益微薄,科笛集團當前尚未盈利。

2020年及2021年,科笛集團母公司普通股持有人應佔虧損分别為1.05億元及3.2億元,2022年上半年虧損額同比增長100.62%至2.52億元。
02一款藥版權費1個億
除了兩款已上市的產品外,科笛集團目前正在開發五個臨床階段及四個臨床前階段候選藥物。在五個臨床階段候選藥物中,有兩款產品已在海南樂城開始試點商業化。
該兩款正展開試點商業化的產品分别為CU-40102(外用非那雄胺噴霧劑)及CU-10201,均是科笛集團的重點產品。
其中,CU-40102亦是授權引進的產品,公司在2020年11月獲Polichem授權以開發、使用、銷售等方式將CU-40102商業化用於治療雄激素性脫發的權利,為此,公司向Polichem支付了總額為1380萬歐元(約1.01億元人民幣)的首期付款及最高里程碑付款。
據悉,CU-40102是全球首個亦是唯一一個獲批準用於雄激素性脫發治療的外用非那雄胺產品,也是中國唯一一個處於臨床開發階段的外用非那雄胺產品。
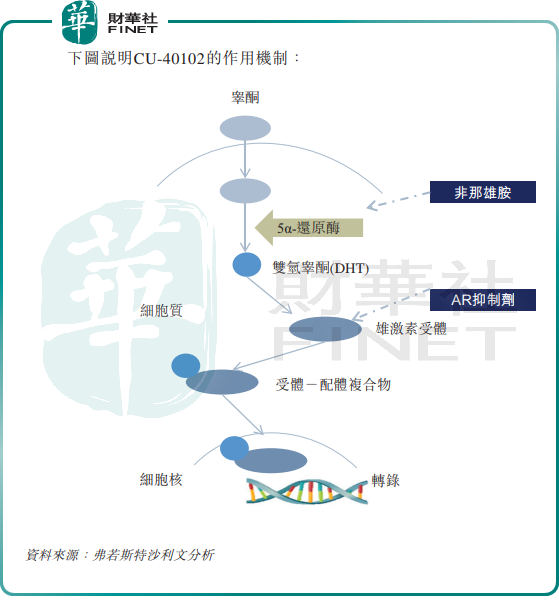
CU-40102能否順利實現商業化還有待商榷,CU-40102雖然是目前中國脫發治療的主流藥品及唯一的口服藥品,並且有較高的科技壁壘,但其通常涉及全身副作用。
III期臨床試驗數據顯示,治療緊急不良事件為鼻咽炎(CU-40102組為15.5%,賦形劑組為13.3%,口服非那雄胺組為17.9%)及頭痛(CU-40102組為9.4%,賦形劑組為11.0%,口服非那雄胺組為9.5%)。CU-40102組的治療後緊急副作用的總體發生率(41.4%)與賦形劑組相似(42.0%),略低於口服非那雄胺組(48.8%)。
CU-40102預計要到2023年第四季度才完成III期臨床試驗的主要終點讀出,公司計劃於2023年第四季度向國家藥監局提交NDA,並預計於2024 年獲得在中國進行商業化運作的監管批準。
CU-10201方面,CU-10201 是全球首個亦是唯一一個獲批準用於尋常痤瘡治療的外用米諾環素,也是中國唯一一個處於臨床開發階段的外用米諾環素。
CU-10201亦是一款授權而獲得的藥物,公司在2020年4月獲得CU-10201在大中華區的獨家開發及商業化權利。
CU-10201預計在2023年第一季度完成III期臨床試驗的主要終點讀出,計劃於2023年第四季度向國家藥監局提交NDA,並預期於2024年第四季度獲得在中國進行商業化的監管批準。
同樣,科笛集團獲得CU-10201的許可和權利也花費了不少資金,公司向醫藥公司Foamix支付的預付款項及最高里程碑付款總額達1100萬美元,折合人民幣約7642萬元。
03 核心產品商業化尚需時日
科笛集團只有一款核心產品,該款產品名為CU-20401,用於治療颏下脂肪堆積以及腹部脂肪堆積,目前處於II 期臨床試驗階段。
臨床數據顯示,CU-20401可有效減少過多的脂肪堆積,具有良好的安全性。公司預計於2023年第三季度啓動CU-20401治療颏下脂肪堆積的II期臨床試驗。
CU-20401是由科笛集團通過收購的方式而得。在2020年8月,杭州觀蘇向科笛集團獨家轉讓了CU-20401在亞洲的所有相關知識產權及研發成果,科笛集團可就潛在適應症開發、生產及商業化CU-20401,為此科笛集團支付了6000萬元的不可退還前期費用及開發里程碑付款。
與其他治療手段相比,局部脂肪堆積管理藥物具有創傷小、患者配合度高、術後疼痛小、使用方便、恢復快等特點。但目前國内局部脂肪堆積管理藥物市場仍處於初期增長階段,尚無獲批產品。該市場前景廣闊,且增長迅速,根據弗若斯特沙利文資料,國内局部脂肪堆積管理藥物的市場規模預計將由2023年的1.35億元增長至2025年的8.05億元,復合年增長率高達144.7%。
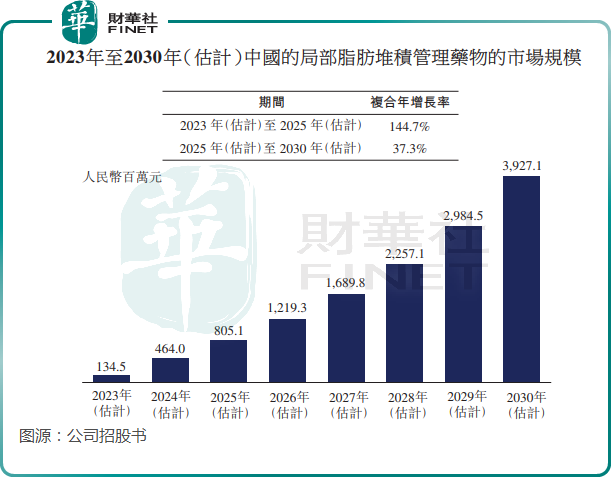
目前,中國有三個局部脂肪堆積管理候選藥物產品處於臨床試驗階段。除了科笛集團的CU-20401外,還有南京諾瑞特的脫氧膽酸(目前處於III期階段)以及南京邁諾威的脫氧膽酸(已獲IND批準)。
根據弗若斯特沙利文的資料,CU20401有望成為國内首個獲批的局部脂肪堆積管理藥物。
科笛集團對CU20401抱有很高的期待,其計劃將部分上市募資所得款用於CU-20401的持續臨床開發活動和登記備案、批準後研究以及相關研發人員及活動的成本及開支,以及用於CU-20401本地生產和商業化。
04獲多輪融資背後,債務結構仍有待優化
在此次向港交所遞交招股書之前,科笛集團共完成了三輪融資,累計融資2.75億美元。

在投資方中,包括紅杉資本、泰康保險全資子公司TK Derma Limited、金湧資本管理的投資組合GHFFSP、清池資本(香港)有限公司管理的LBC等。
目前,科笛集團的控股股東通和毓承實體持有公司53.57%股權,YF Dermatology Limited為公司第二大股東,持股14.15%,紅杉中國持股12.13%,為公司第三大股東。
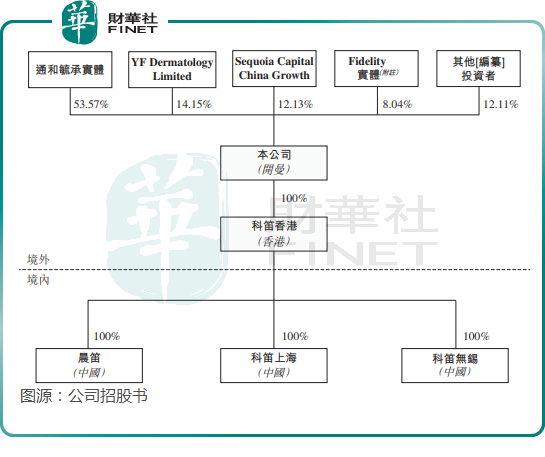
儘管過去幾年獲得多輪融資,但科笛集團因產品商業化效果不佳,且近幾年保持高研發投入,使公司面臨著較大的資金壓力。
公司在招股書中表示:「2020年、2021年及2022年上半年,我們分别產生總虧绌(總資產減去總負債)5.12億元、7.91億元及10.04億元。總虧绌可能使我們面臨流動資金短缺的風險,繼而需要我們從諸如外債或發售我們的股權等來源尋求充分的資金,而此類資金可能無法按對我們有利或商業上合理的條款獲得,甚或根本無法獲得。」
財華網所刊載內容之知識產權為財華網及相關權利人專屬所有或持有。未經許可,禁止進行轉載、摘編、複製及建立鏡像等任何使用。
如有意願轉載,請發郵件至content@finet.com.hk,獲得書面確認及授權後,方可轉載。
更多精彩內容,請登陸
財華香港網 (https://www.finethk.com/)
財華智庫網(https://www.finet.com.cn)
現代電視 (https://www.fintv.hk)