10月30日,港股市場的生物科技股迎來普漲,百濟神州(06160.HK)、信達生物(01801.HK)、雲頂新耀-B(01952.HK)等多股表現不俗。
君實生物(01877.HK)則在早盤一度跳漲近15%,此後雖然有所回落,但截至收盤仍放量大漲8.22%。其A股亦遭遇了高開回落,但截至收盤漲幅仍有5.47%。
值得一提的是,除了受生物科技板塊行情的影響外,君實生物的大漲其實還有利好消息的刺激。
首個國產PD-1美國獲批
日前,君實生物發佈公告稱,公司的合作夥伴Coherus(CHRS.US)收到美國食品藥品監督管理局(簡稱「FDA」)的通知,特瑞普利單抗(美國商品名:LOQTORZI™)聯合順鉑/吉西他濱作為轉移性或復發性局部晚期鼻咽癌成人患者的一線治療,以及作為單藥治療既往含鉑治療過程中或治療後疾病進展的復發性、不可切除或轉移性鼻咽癌的成人患者的生物制品許可申請已獲得批準。
特瑞普利單抗成為了美國首款且唯一獲批用於鼻咽癌治療的藥物,也是FDA批準上市的首個中國自主研發和生產的創新生物藥。
根據資料,特瑞普利單抗是中國首個批準上市的以PD-1為靶點的國產單抗藥物,至今已在全球(包括中國、美國、東南亞及歐洲等地)開展了覆蓋超過15個適應症的40多項由君實生物發起的臨床研究。截至目前,特瑞普利單抗的6項適應症已於中國獲批,當下已有3項適應症納入國家醫保目錄(2022年版)。
近些年來,國内的創新藥企紛紛選擇「出海」。特瑞普利單抗也是君實生物進行國際化佈局的「利器」,此次在美獲批也意味著該公司在「出海」方面取得了重要進展。
而除了在美國獲批外,君實生物也已向歐洲藥品管理局(EMA)和英國藥品和保健品管理局(MHRA)提交了特瑞普利單抗聯合順鉑和吉西他濱,用於局部復發或轉移性鼻咽癌患者的一線治療,以及聯合紫杉醇和順鉑用於不可切除局部晚期/復發或轉移性食管鱗癌患者的一線治療的上市許可申請(MAA)並獲得受理。
特瑞普利單抗在美獲批有多大影響?
君實生物在公告中稱,此次特瑞普利單抗在美獲批將進一步推進公司國際化佈局的進程,提升公司產品的國際影響力,有望對公司長期經營業績產生積極影響。
具體而言,根據君實生物和Coherus於2021年簽署的合作協議,Coherus向君實生物一次性支付1.5億美元首付款(不可退回),並將在達到相應里程碑事件後向公司支付累計不超過3.8億美元的里程碑付款,外加任何包含特瑞普利單抗的產品在Coherus區域内(美國和加拿大)年銷售淨額20%的銷售分成。
另外,Coherus每年將支付最多2500萬美元的合作開發費用。
而鼻咽癌是常見的頭頸部惡性腫瘤之一。據世界衛生組織統計,2020年鼻咽癌在全球範圍内確診的新發病例數超過13萬。由於原發腫瘤位置的原因,很少採用手術治療,針對局限性癌症主要採用放療或放化療結合進行治療,此前,美國尚無療法獲批用於治療鼻咽癌,因此特瑞普利單抗獲批填補了美國鼻咽癌的治療空白。
Coherus在電話會中表達了對特瑞普利單抗的樂觀預期,認為它在鼻咽癌適應症的峰值銷售額將達到2億美元。
安信證券也在最新研報中稱,未來特瑞普利單抗在Coherus區域内的銷售放量值得期待。
方正證券的研究人員則表示,特瑞普利的成功出海驗證了其結構及臨床結果的優異性,有望在海外全覆蓋鼻咽癌的免疫治療,成為治療新標準。與此同時,首次獲批美國上市,打開了君實生物佈局海外產品上市的通道,為其他產品聯用特瑞普利在海外上市奠定了基礎。另外,特瑞普利在美獲批上市為其在其他地區上市奠定了基礎。
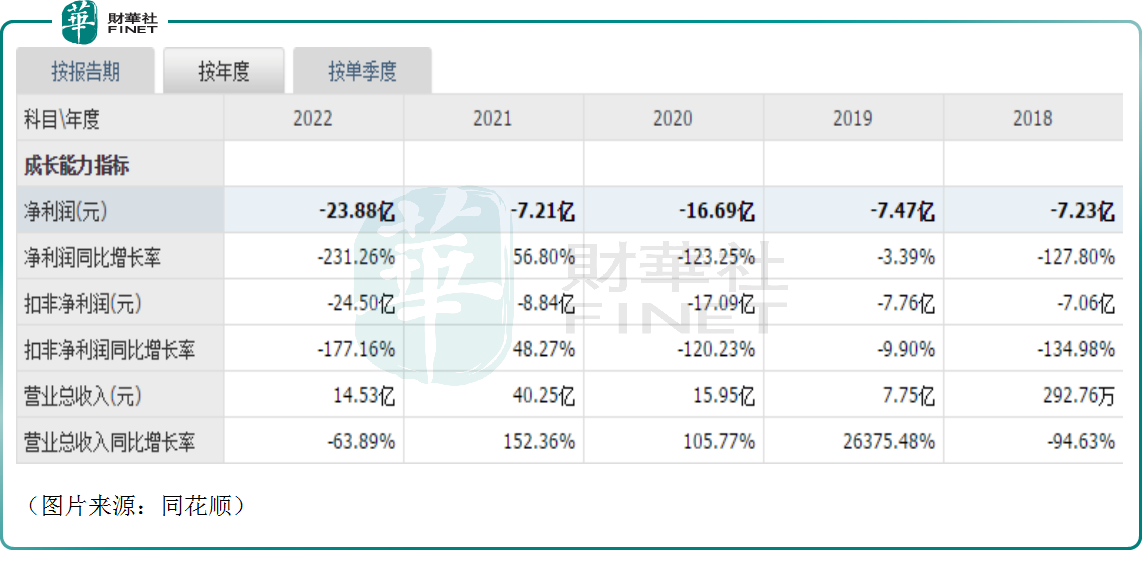
需要指出的是,作為國内創新藥龍頭之一,君實生物近些年取得了很多成績,但是該公司面臨的一大問題是持續虧損。
按照中國會計準則,2020年—2022年期間,君實生物歸母淨利潤分别虧損16.69億元(人民幣,下同)、7.21億元、23.88億元。
而10月27日的公告顯示,2023年前三季度,該公司的歸母淨利潤虧損了14.07億元,同比收窄了11.78%。
展望未來,伴隨著「出海」成功,特瑞普利單抗有望為君實生物扭虧為盈提供重要助力。
結語
2022年2月,信達生物首款國產PD-1衝擊在美國上市失敗,給業界帶來了不小的衝擊。百濟神州、基石藥業等創新藥企的「出海」也接連遭遇「退貨」。如今,特瑞普利單抗成功在美獲批,也彰顯了君實生物的實力,其未來發展值得關注。
財華網所刊載內容之知識產權為財華網及相關權利人專屬所有或持有。未經許可,禁止進行轉載、摘編、複製及建立鏡像等任何使用。
如有意願轉載,請發郵件至content@finet.com.hk,獲得書面確認及授權後,方可轉載。
更多精彩內容,請登陸
財華香港網 (https://www.finethk.com/)
財華智庫網(https://www.finet.com.cn)
現代電視 (https://www.fintv.hk)