
2021年9月末,有著淡馬錫、禮來(LLY.US)、高瓴等明星股東加持的創勝集團-B(06628.HK),風風光光地登陸了港股市場,成為了生物科技板塊的一員。
到如今,將近兩年的時間過去了,市場高增長預期,創勝集團並未兌現,股價表現不儘如人意。
實際上,創勝集團上市沒多久就開始一路走低,一度跌超60%,直到2023年二季度才迎來了一波像樣的反彈。不過,創勝集團股價的萎靡在很大程度上也是受到了市場環境的影響,畢竟自2021年9月末以來,恒生指數就累跌了約26%。
值得一提的是,就在2023年,創勝集團開始持續回購自己的股份,其CEO亦在不斷地增持,這些積極舉措彰顯了對公司發展前景的看好,也提振了投資者的信心。
CDMO業務持續貢獻營收,創勝集團加碼研發
創勝集團是一家具備發現、研究、開發及制造綜合能力的臨床階段生物制藥公司。
截至2023年中期,創勝集團已建立涵蓋13種用於腫瘤、骨質病變及腎病的多元化及差異化分子管線。其中,大多數候選抗體是由創勝集團的抗體開發平台内部開發,涵蓋已驗證的、部分驗證的及新型生物通路,而一種候選管線藥物以授權引進的方式取得,詳情如下圖所示:
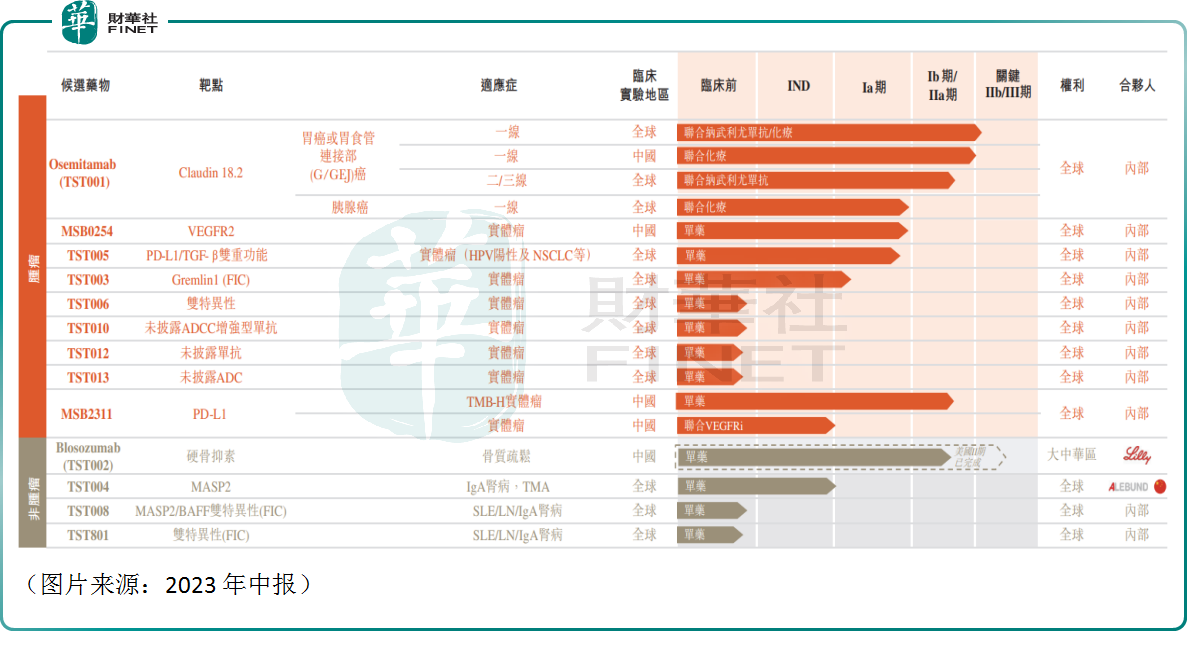
雖然是一家創新藥企,但和港股市場許多生物科技企業一樣,創勝集團上市兩年仍沒有產品實現商業化。而好消息在於,該公司的CDMO業務已經能持續貢獻收入。
數據顯示,2021年、2022年,創勝集團的CDMO業務分别實現收入約0.44億元(人民幣,下同)、0.88億元,而同期的總營收分别為0.5億元、1.02億元。
2023年上半年,該公司的營收同比增長65.84%至0.36億元,主要系CDMO業務取得進展。
中報顯示,今年上半年,創勝集團CDMO業務在中國及美國增加了超過12名新客戶,擴大了在培養基開發、ADC開發、凍幹制劑、分析檢測、配方研究、顆粒調查及藥品灌裝及封存方面的服務。
不過,創勝集團在上半年加大了研發投入,期内的研發開支同比增長22.09%至2.08億元。而加碼研發也導致了該公司上半年的淨利潤虧損同比擴大16.45%至2.38億元。
從研發開支的組成部分來看,研發開支增加的部分主要是臨床開支,而臨床前開支則遭到了削減。

以上研發開支組成部分的變化表明創勝集團正集中「火力」於臨床階段的研發,而暫時放緩了臨床前階段的投入。
數據顯示,截至2023年中期末,創勝集團的銀行結餘及現金、已抵押銀行存款及定期存款為8.14億元。
由此可見,該公司的現金流其實還沒到很緊張的程度,當然也稱不上特别「富裕」。之所以在加大臨床階段研發,而削減臨床前投入的原因或許是想集中「財力」攻關臨床階段的某一款或某一些產品,以期帶動全局的改善。
押注核心產品TST001,擁有廣闊前景?
結合管線來看,這款被寄予厚望的產品很可能就是創勝集團的核心產品TST001。
Osemitamab(TST001)是一種用於實體瘤的人源化ADCC增強型Claudin18.2單抗,是該公司的關鍵候選藥物之一。
Claudin18.2其實是一種通常在多種癌症(包括胃癌、胰腺癌、食管癌及其他癌症)中表達的緊密連接蛋白。Claudin18.2可以說是胃癌領域的實力靶點。
2023年中報披露,靶向Claudin18.2抗體Osemitamab(TST001),於聯合化療的Ib期研究中對廣泛的Claudin18.2表達腫瘤患者表現出令人鼓舞的療效結果和良好的安全性。
創勝集團也宣佈,於2023年3月,公司獲得美國FDA就Osemitamab(TST001)頒發的孤兒藥資格認定,用於治療胰腺癌患者。
另外,該公司已獲得中國國家藥品監督管理局藥品審評中心(CDE)和韓國食品藥品安全部(MFDS)監管批準,開展Osemitamab(TST001)的全球III期關鍵性試驗。此試驗將測試Osemitamab(TST001)聯合納武利尤單抗與化療一線治療HER2陰性、Claudin18.2表達的局部晚期或轉移性胃癌或胃食管連接部(G/GEJ)腺癌患者的療效。
國元國際發佈的報告顯示,預計2030年美國和中國的Claudin18.2抑制劑市場規模將分别達到18億美元和17億美元,2035年將分别達到40億美元和37億美元。
不過,在Claudin18.2靶點開發領域,競爭者可是不少,涉及榮昌生物(09995.HK)、信達生物(01801.HK)等多家藥企。
Osemitamab(TST001)是全球第2款進入三期臨床Claudin18.2抗體,僅次於安斯泰來,稱得上是「兵貴神速」,先發優勢明顯。
國元國際稱,TST001為第二代Claudin18.2靶向抗體治療候選藥物,憑借高親和力、更強的ADCC作用、中美兩地申報、同步開發伴隨診斷、患者覆蓋群體廣、連續灌流生產工藝這五大優勢,在胃癌、胰腺癌和膽管癌治療上有著廣闊的市場前景。
這些產品的研發進展值得關注
除了Osemitamab(TST001)這款產品外,創勝集團的MSB2311、Blosozumab(TST002)的研發進度也比較靠前。
其中,TST002(Blosozumab)是一種治療骨質疏松的人源化硬骨素單克隆抗體,於2019年從禮來授權引進大中華區,是創勝集團的主要產品之一。
據悉,禮來已於美國及日本完成對Blosozumab用於絕經後婦女的II期試驗,並顯示可誘導脊柱、股骨頸及全髋關節骨密度(BMD)較安慰劑有統計學意義上顯著的劑量依賴性增加。在最高劑量組中,與基線相比,於12個月内Blosozumab治療令脊柱BMD升高了17.7%,全髋關節BMD升高了6.2%。
而創勝集團於2023年已完成了Ia期遞增研究,並在單劑TST002給藥後觀察到振奮人心的TST002的BMD增加活性。於2023年6月,該公司獲得中國藥審中心對在中國骨質疏松症患者中啓動II期臨床研究的批準。
而MSB2311是一種針對實體瘤的人源化PD-L1單抗候選藥物,為第二代PD-L1抑制劑,較其他PD-(L)1抗體具有pH依賴性結合PD-L1的獨特性。
不過,創勝集團在中報中表示,由於PD-L1產品的競爭格局及大幅降價,故計劃取消MSB2311的優先級,並會將資源轉移至Osemitamab(TST001),原因為Osemitamab(TST001)具有更大的競爭優勢及商業潛力。MSB2311將被保留用於未來聯合研究。
除此之外,TST003(一種同類首創人源化抗GREMLIN-1抗體)、TST005(一種用於實體瘤的PD-L1/TGF-β雙重功能融合蛋白)的研發也已進入了臨床階段,後續進展值得關注。
結語
值得注意的是,進入三期臨床並不代表就萬事大吉了,即使三期臨床結果很好,但走過三期臨床,走到商業化不僅需要較長的時間,還需要充足的「財力」支持。
創勝集團削減臨床前的投入,集中「火力」於臨床階段的做法的確有利於幫助企業應對當前局面,在一定程度上提升「突破」的成功率,不過最後能否真的研發成功,並達到「破其一點,帶動全局」的效果仍然很難說。
更多精彩內容,請登陸
財華香港網 (https://www.finethk.com/)
現代電視 (http://www.fintv.com)